Журнал «Медицина неотложных состояний» №2(97), 2019
Вернуться к номеру
Удосконалення методу штучного кровообігу при кардіохірургічних втручаннях
Авторы: Черній В.І., Собанська Л.О., Тополов П.О., Лазаренко О.Н., Алексєєва Т.А., Гур’янов В.Г.
ДНУ «Науково-практичний центр профілактичної та клінічної медицини» ДУС, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Використання контура екстракорпорального кровообігу залишається важливою проблемою при кардіохірургічних операціях. Удосконалення методик штучного кровообігу (ШК) не втрачає актуальності і в сучасних умовах. Мета: удосконалити метод штучного кровообігу при проведенні кардіохірургічних втручань за рахунок модифікації поверхні контура штучного кровообігу й внутрішньовенного введення фруктозо-1,6-дифосфату. Матеріали та методи. На базі ДНУ «Науково-практичний центр профілактичної та клінічної медицини» ДУС були обстежені 64 кардіохірургічні хворі, прооперовані із використанням штучного кровообігу. Пацієнти були поділені на 3 групи: Gr1 — пацієнти, яким проводився ШК з використанням езафосфіни (n = 22); Gr2 — пацієнти, яким проводився ШК із використанням екстракорпорального контура, обробленого адаптуючою композицією (n = 21), і Gr3 — група контролю (n = 21). У хворих у кожній групі робили мазки й виконували загальний аналіз крові, вивчали морфометрію мазків крові, еритроцитарні індекси, кислотно-лужний стан, гемоліз і рівень фосфатів. Дослідження проводили перед початком перфузії, на 10, 40, 60-й хвилині (етап зігрівання) штучного кровообігу й через годину після відключення апарата штучного кровообігу. Результати. Показано, що зниження показників гемоглобіну, еритроцитів, гематокриту в усіх трьох групах відбувається за рахунок гемодилюції внаслідок використання розчинів для кардіоплегії. При використанні препарату езафосфіна й обробці контура оксигенатора адаптуючою композицією показник гемолізу після ШК менш виражений, ніж у контрольній групі (p < 0,05). Гіпофосфатемія є недооціненою проблемою в кардіохірургічних хворих. У Gr1 введення езафосфіни дозволило скоригувати гіпофосфатемію (р < 0,001). У Gr2 рівень фосфору наприкінці перфузії суттєво не відрізнявся від початкових значень (р = 0,07). У Gr3 рівень фосфору після ШК зменшився (р < 0,001), що свідчить про енергетичний дефіцит у даної категорії хворих. Зміни показників змішаної венозної сатурації вірогідно відображають адекватність споживання кисню. Напруга кисню в змішаній венозній крові у Gr1, у якій застосовувалася езафосфіна, протягом ШК була істотно вищою, ніж у Gr3 (p < 0,05). При аналізі морфометрії мазків крові встановлено, що в контрольній групі у процесі ШК починаючи з 10-ї хвилини спостерігається тенденція до трансформації еритроцитів в ехіноцити, які після штучного кровообігу переважають в полі зору порівняно з періодом до ШК (p < 0,05). Після ШК у полі зору з’являються ехіноцити, мікроцити й еритроцити у формі бублика. При аналізі морфометрії мазків крові в Gr1 і Gr2 встановлено, що дискоцити меншою мірою трансформуються в ехіноціти, і на 40-й хвилині ШК кількість нормоцитів вірогідно не відрізняється від показників до ШК (p > 0,05). Висновки. Доведена доцільність використання езафосфіни й адаптуючої композиції під час виконання штучного кровообігу при кардіохірургічних втручаннях. Запропоновані методики приводять до корекції гіпофосфатемії, покращують постачання клітин киснем, підвищують опірність гемолізу, збільшують запас багатих енергією фосфорних сполук. Відзначається позитивний вплив на морфометричний стан еритроцитів. Кращі показники змішаної венозної сатурації відзначаються при використанні езафосфіни.
Актуальность. Использование контура экстра-
корпорального кровообращения остается важной проблемой при кардиохирургических операциях. Совершенствование методик искусственного кровообращения (ИК) не перестает быть актуальным и в современных условиях. Цель: усовершенствовать метод искусственного кровообращения при проведении кардиохирургических вмешательств за счет модификации поверхности контура искусственного кровообращения и внутривенного введения фруктозо-1,6-дифосфата. Материалы и методы. На базе ГНУ «Научно-практический центр профилактической и клинической медицины» ГУД обследовали 64 кардиохирургических больных, прооперованных с использованием искусственного кровообращения. Пациенты были разделены на 3 группы: Gr1 — пациенты, которым проводилось ИК с использованием эзафосфины (n = 22); Gr2 — пациенты, которым проводилось ИК с использованием экстракорпорального контура, обработанного адаптирующей композицией (n = 21) и Gr3 — группа контроля (n = 21). У больных в каждой группе делали мазки и выполняли общий анализ крови, изучали морфометрию мазков крови, эритроцитарные индексы, кислотно-щелочное состояние, гемолиз и уровень фосфатов. Исследование проводили перед началом перфузии, на 10, 40, 60-й минуте (этап согревания) искусственного кровообращения и через час после отключения аппарата искусственного кровообращения. Результаты. Показано, что снижение показателей гемоглобина, эритроцитов, гематокрита во всех трех группах происходит за счет гемодилюции вследствие использования растворов для кардио-плегии. При использовании препарата эзафосфина и обработке контура оксигенатора адаптирующей композицией показатель гемолиза после ИК менее выраженный, чем в контрольной группе (p < 0,05). Гипофосфатемия является недооцененной проблемой в кардиохирургических больных. В Gr1 введение эзафосфины позволило скорректировать гипофосфатемию (р < 0,001). В Gr2 уровень фосфора в конце перфузии существенно не отличался от начальных значений (р = 0,07). В Gr3 уровень фосфора после ИК уменьшился (Р < 0,001), что свидетельствует о энергетическом дефиците у данной категории больных. Изменения смешанной венозной сатурации достоверно отражают адекватность потребления кислорода. Напряжение кислорода в смешанной венозной крови в Gr1, в которой применялась эзафосфина, в течение ИК было существенно выше, чем в Gr3 (p < 0,05). При анализе морфометрии мазков крови установлено, что в контрольной группе в процессе ИК начиная с 10-й минуты наблюдается тенденция к трансформации эритроцитов в эхиноциты, которые после ШК превалируют в поле зрения по сравнению с периодом до ИК (p < 0,05). После ИК в поле зрения появляются эхиноциты, микроциты и эритроциты в форме бублика. При анализе морфометрии мазков крови в Gr1 и Gr2 установлено, что дискоциты в меньшей мере трансформируются в эхиноциты и на 40-й минуте ИК количество нормоцитов достоверно не отличается от показателей до ИК (p > 0,05). Выводы. Доказана целесообразность использования эзафосфины и адаптирующей композиции при осуществлении искусственного кровообращения при кардиохирургических вмешательствах. Предложенные методики приводят к коррекции гипофосфатемии, улучшают снабжение клеток кислородом, повышают сопротивляемость гемолизу, увеличивают запас богатых энергией фосфорных соединений. Отмечается положительное влияние на морфометрическое состояние эритроцитов. Лучшие показатели смешения венозной сатурации отмечаются при использовании эзафосфины.
Background. The use of extracorporeal circuit remains a significant problem during cardiac surgery. Improving the methods of artificial blood circulation is still relevant now. The purpose was to improve the method of cardiopulmonary bypass (CPB) during cardiac surgery due to modification of the surface of extracorporeal circuit and the use of fructose-1,6-diphosphate. Materials and methods. At the premises of Scientific and Practical Center of Preventive and Clinical Medicine, 64 cardiac surgical patients were examined and operated using CPB. The patients were divided into 3 groups: group 1 — those undergoing CPB using esafosfina (n = 22); group 2 — patients undergoing CPB with extracorporeal circuit processed with adapting composition (n = 21) and group 3 — controls (n = 21). In each group, smears and blood tests were done, the morphometry of blood smears was studied, as well as erythrocyte indices, acid-base balance, hemolysis and phosphate levels. The study was carried out before the start of perfusion, then after 10, 40, 60 minutes (warming stage) of cardiopulmonary bypass and one hour after turning off the heart-lung machine. Results. It is shown that a decrease in the hemoglobin, red blood cells and hematocrit values in all three groups is due to hemodilution, the use of solutions for cardioplegia. When using esafosfina and processing the oxygenator circuit by adapting composition, the hemolysis after CPB is lower than in the control group (p < 0.05). Hypophosphatemia is an underestimated problem in cardiac surgery patients. In group 1, the administration of esafosfina allowed correcting hypophosphatemia (р < 0.001).
In group 2, the level of phosphorus by the end of perfusion was not significantly different from the baseline (p = 0.07). In group 3, the level of phosphorus after CPB decreased
(p < 0.001) that indicates an energy deficit in this category of patients. Changes in the mixed venous saturation reliably reflect the adequacy of oxygen consumption. PvO2 in group 1, where esafosfina was used, during CPB was significantly higher than in group 3 (p < 0.05). When analyzing the morphometry of blood smears, it was found that in group 3 (controls) du-ring CPB, starting from 10 minutes, there was a tendency of erythrocytes transformation into echinocytes, which after CPB prevail in the high power field compared to the period before CPB (p < 0.05). After CPB, echinocytes, microcytes and red blood cells appear in the high power field. When analyzing the morphometry of blood smears in groups 1 and 2, it was found that discocytes are less transformed into echinocytes, and after 40 minutes of CPB, the number of normocytes is not significantly different compared to the period before CPB (p > 0.05). Conclusions. The expediency of using esafosfina and adapting composition in artificial blood circulation during cardiac surgery is proved. The proposed methods lead to the correction of hypophosphatemia, improve the supply of cells with oxygen, increase resistance to hemolysis, increase the supply of energy-rich phosphorus compounds. A positive effect on the morphometric state of erythrocytes is noted. The indicators of mixed venous saturation are best when using esafosfina.
штучний кровообіг; екстракорпоральний контур; оксигенатор; гіпофосфатемія; фруктозо-1,6-дифосфат; адаптуюча композиція; морфометрія еритроцитів
искусственное кровообращение; экстракорпоральный контур; оксигенатор; гипофосфатемия; фруктозо-1,6-дифосфат; адаптирующая композиция; морфометрия эритроцитов
cardiopulmonary bypass; extracorporeal circuit; oxygenator; hypophosphatemia; fructose-1,6-diphosphate; adapting composition; erythrocyte morphometry
Вступ
Сучасний розвиток кардіохірургії тісно пов’я–заний із досягненнями в розвитку екстракорпоральних технологій. У багатьох аспектах від якості штучного кровообігу (ШК) залежить безпосередній і віддалений результат кардіохірургічних втручань. Незважаючи на постійне удосконалення методів штучного кровообігу, покращання перфузійних технологій, не вдається остаточно уникнути низки проблем, що виникають при проведенні перфузії. Організм пацієнтів під час кардіохірургічних операцій піддається періопераційному стресу, а особливу роль у міжсистемній інтеграції при стресі відіграє система крові, зокрема еритроцити [1].
Морфофункціональні характеристики, що забезпечують цілісність еритроцитів, змінюються у зв’язку із застосуванням контура екстракорпорального кровообігу: відбувається механічна й фізико–хімічна травма формених елементів крові, деструкція еритроцитів під час циркуляції крові в апараті штучного кровообігу, роботи роликових або центрифужних насосів, застосування артеріального фільтра, кардіотомного відсмоктування, пасажу крові в ме–
жах оксигенатора й артеріальної канюлі, виникнення турбулентних потоків в місцях перехідних перетинів екстракорпорального контура [2, 5]. Вплив цих факторів ініціює внутрішньосудинний гемоліз, який відіграє важливу роль у формуванні ранніх післяопераційних ускладнень і може привести до розвитку синдрому поліорганної недостатності у хворих, оперованих в умовах ШК [3]. Еритроцит до певної межі здатний протистояти таким осмотичним, механічним, хімічним, температурним впливам. Це характеризується поняттям резистентності, що визначається станом мембрани еритроцита [4]. У той же час відомо, що при виконанні штучного кровообігу в рівних умовах із використанням ідентичного обладнання ступінь вираженості гемоглобінемії виявляється нерівнозначним [6]. Це свідчить про індивідуальні особливості мембран еритроцитів, що визначають транспортні, антигенні й мікрореологічні властивості даного типу клітин і впливають на їх гемолітичну стійкість при перфузії [7].
У роботах низки авторів показано, що стан мембрани й здатність еритроцитів до деформації значною мірою залежить від внутрішньоклітинного вмісту аденозинтрифосфату (АТФ): при зниженні рівня АТФ деформованість зменшується, при підвищенні — зростає [8]. Енергія має велике значення для забезпечення цілісності мембрани й двоввігнутої форми еритроцитів, здатності до виконання кисневотранспортної функції [9, 10]. Процес зміни форми еритроцита — це його трансформація з дискової у сферичну форму. Є два шляхи такої трансформації: 1) ехіноцитоз, коли поверхня еритроцита вкривається шипами конусоподібної форми, близькими за розмірами; 2) стомацитоз, коли еритроцити зберігають гладеньку поверхню, але набувають вигляду однобічно увігнутого диска. Перший варіант трансформації еритроцита є результатом дії жирних кислот, нестачі АТФ, підвищення рН. Другий варіант спостерігається при зниженні рН, під дією катіонних препаратів. Подальша трансформація еритроцитів проходить етапи сфероехіноцитозу, сферостоматоцитозу, а кінцевий етап трансформації сфероцита — це утворення найжорсткішої структури, що передує звичайному руйнуванню клітини. Трансформація еритроцита завжди призводить до зниження його здатності до деформації [10]. Популяція еритроцитів неоднорідна за формою й розміром. У крові здорової людини основну масу (80–90 %) становлять еритроцити двоввігнутої форми — дискоцити. Окрім того, можуть бути наявні планоцити (з плоскою поверхнею) і старіючі форми еритроцитів — шилоподібні еритроцити, або ехіноцити (~ 6 %), куполоподібні, або стоматоцити (~ 1–3 %), і м’ячеподібні, або сфероцити (~ 1 %).
Одним із механізмів порушення енергетичного забезпечення процесів внутрішньоклітинного го–меостазу в еритроцитах є гіпофосфатемія. Метааналіз оцінює її поширеність так: 30–34 % — у пацієнтів блоків реанімації, 70–78 % — у хворих на штучній вентиляції легень. Встановлено значне поширення гіпофосфатемії в кардіохірургічних хворих — від 34,3 до 50 % пацієнтів [11, 12]. В основі більшості проявів гіпофосфатемії лежить дефіцит АТФ і креатинфосфату в клітинах у зв’язку зі зниженням у них рівня фосфату. Останній необхідний для фосфорилювання глюкози, аденіннуклеотидів і креатину [12]. Тому рекомендована часта лабораторна перевірка й корекція гіпофосфатемії. Незважаючи на це, моніторинг фосфатів, як і раніше, не є рутинним обстеженням у таких пацієнтів. Відповідно, треба знати: коли показана внутрішньовенна терапія фосфатом, скільки потрібно вводити фосфату, як швидко фосфат повинен бути введений. Існують поодинокі роботи, у яких наведені різні цитопротекторні стратегії, направлені на пряме підвищення рівня високоенергетичних фосфатів (АТФ) у міокарді. До препаратів, що безпосередньо підвищують АТФ, належить фруктозо–1,6–дифосфат (ФДФ), ендогенний високоенергетичний проміжний метаболіт гліколітичного шляху, що посилює утворення АТФ. Введення ФДФ може запобігти шкідливим наслідками очікуваного періоду ішемії з наступною реперфузією, тим самим покращити функцію міокарда в пацієнтів після ШК [13]. На фармакологічному ринку України препаратом, що містить фруктозо–1,6–дифосфат, є езафосфіна, засіб широкого спектра дії. Клінічні дослідження підтвердили, що терапія езафосфіною швидко і ефективно збільшує вміст 2,3–дифосфогліцерату (2,3–ДФГ) у крові, концентрацію кисню без збільшення навантаження на серце. Підвищення стійкості еритроцитів до гемолізу дозволяє використовувати езафосфіну при застосуванні різних методів лікування пацієнтів зі штучним кровообігом [14]. Встановлено клітинні механізми дії езафосфіни: стимуляція процесу насичення тканин киснем за рахунок підвищення рівня 2,3–дифосфогліцерату в еритроцитах, поляризації мембрани й полегшення проникнення в клітину іонів К+, виведення іонів Na+ і блокування входу Са2+, підвищення стійкості еритроцитів до гемолізу, покращання обміну глюкози інсулінонезалежним шляхом. Езафосфіна підвищує перфузію й оксигенацію тканин, зміщує криву дисоціації оксигемоглобіну вліво за рахунок синтезу 2,3–ДФГ еритроцитів, перешкоджає гемолізу еритроцитів [14].
Іншим важливим механізмом, що впливає на морфофункціональний стан формених елементів крові, є контакт крові із синтетичною поверхнею екстракорпорального контура, який стає тригером розвитку системної запальної відповіді (СЗВ) [15]. Розвиток синдрому системної запальної відповіді обумовлений досить великою площею контакту з неендотелізованою поверхнею екстракорпорального контура й відсутністю повної біосумісності його матеріалів із кров’ю [16, 17]. Клітини периферичної крові одними з перших реагують на розвиток синдрому СЗВ, вступають у різні міжклітинні взаємодії, залучаючись до секреції про– та протизапальних медіаторів, розвитку ендотеліальної дисфункції й імунної відповіді [18]. Розвиваються структурно–функціональні зміни клітинних мембран, їх взаємодії з білками цитоскелета [19].
На поверхні оксигенатора є спеціальні місця зв’язування — епітопи, що розпізнаються захисними елементами імунної системи імуноглобулінами класу G (IgG) реципієнта як чужорідні. Утворення афінного зв’язку між поверхнею оксигенатора й IgG (антигеном і антитілом) призводить до активації клітинного імунітету реципієнта, у подальшому проявляється місцевим асептичним запаленням [20, 21].
Біосумісністю вважається властивість чужорідного матеріалу не викликати патологічної реакції при контакті з кров’ю людини. Технологія застосування адаптуючої композиції (АК) направлена на досягнення нівелювання сигналу «свій/чужий». У дослідженні, проведеному фахівцями Інституту хімії поверхні ім. О.О. Чуйка НАН України, було встановлено, що нанесення розчину альбуміну низької концентрації автосироватки крові реципієнта на поверхню імпланта дозволяє утворити шар білка товщиною в одну молекулу. Завдяки подібному захисному наношару імунна система не реагує на імплант як на чужорідний об’єкт [20, 22]. В експериментах in vitro було показано, що обробка магістралей АК суттєво впливає на ступінь адсорбції на них клітин крові. Клінічні дослідження підтвердили результати експериментальних спостережень [22, 23].
Метою дослідження було підвищити ефективність штучного кровообігу при кардіохірургічних операціях шляхом зменшення негативного впливу перфузії на морфофункціональний стан формених елементів крові за рахунок: 1) визначення можливості й розробки методики застосування внутрішньовенного введення езафосфіни при оперативних втручаннях із використанням екстракорпорального кровообігу для покращання пластичності еритроцитів і підвищення їх опірності гемолізу, зниження травми формених елементів крові; 2) модифікації поверхні контура штучного кровообігу за рахунок індивідуальної наноадаптації поверхні екстракорпорального контура при використанні адаптуючої композиції.
Матеріали та методи
Для вирішення поставленого завдання на базі ДНУ «Науково–практичний центр профілактичної та клінічної медицини» ДУС було обстежено 64 кардіохірургічних хворих, прооперованих із застосуванням штучного кровообігу. Пацієнти були поділені на 3 групи: Gr1 — пацієнти, яким виконувався ШК із використанням езафосфіни (n = 22); Gr2 — пацієнти, яким виконувався ШК із використанням екстракорпорального контура, обробленого адаптуючою композицією (n = 21 хворий); Gr3 — група контролю (n = 21), у якій виконували операції без обробки контура штучного кровообігу адаптуючою композицією і не використовували препарат езафосфіна.
У Gr1 було 7 (31,8 %) жінок і 15 (68,2 %) чоловіків, у Gr2 — 4 (19,0 %) жінки і 17 (81,0 %) чоловіків, у групі контролю (Gr3) — 7 (33,3 %) жінок і 14 (66,7 %) чоловіків, відмінність між групами не була статистично значимою (p = 0,53). Середній вік пацієнтів у Gr1 становив 63,0 ± 10,2 року, у Gr2 — 57,5 ± 7,9 року, у Gr3 — 62,0 ± 7,7 року, не було виявлено відмінності за віком (p > 0,05).
Пацієнти всіх груп були обстежені до оперативного втручання згідно з уніфікованим клінічним протоколом, затвердженим МОЗ України. Ретельно вивчався анамнез, зокрема перенесені оперативні втручання, особливості преморбідного фону, супутні захворювання.
У дослідження були включені пацієнти з ішемічною хворобою серця й хронічною серцевою недостатністю, яким планувалось кардіохірургічне втручання з використанням штучного кровообігу.
Критеріями виключення з дослідження були: спадкова непереносимість фруктози, кліренс креатиніну нижче від 50 мл/хв, гіпернатріємія, гіперфосфатемія, в анамнезі — алергічні реакції на лікарські засоби, які використовувалися при штучному кровообігу, незгода самого пацієнта на участь у науковому дослідженні.
У хворих у кожній групі робили мазки й виконували загальний аналіз крові, вивчали морфометрію мазків крові [23], кислотно–лужний стан і рівень електролітів, гемолізу, фосфатів. Дослідження проводили перед початком перфузії, на 10, 40, 60–й хвилині (етап зігрівання) штучного кровообігу й через годину після відключення апарату штучного кровообігу (АШК).
Препарат езафосфіна використовували за такою схемою: 5 г препарату вводили внутрішньовенно краплинно безпосередньо перед початком перфузії і 5 г — на 30–й хвилині штучного кровообігу. Для розведення препарату надається флакон із розчинником в об’ємі 50 мл. Проводили інфузію препарату зі швидкістю близько 10 мл/хв.
Модифікацію поверхні контура штучного кровообігу адаптуючою композицією виконували згідно з методичними рекомендаціям «Клінічне застосування обробки поверхні імплантатів адаптуючою композицією для поліпшення їх біосумісних властивостей у реконструктивно–відновлювальній хірургії», 58.16/140.16 (2016) [20].
Схема обробки адаптуючою композицією магістралей оксигенатора: 1) забір у пацієнта з центральної вени 20 мл крові; 2) відстоювання крові протягом 15 хвилин для формування згустка; 3) отримання сироватки методом центрифугування протягом 7 хв при 3500 об/хв; 4) отриману сироватку відбирали стерильним шприцом, доводили об’єм до 15 мл фізіологічним розчином і вводили в оксигенатор через разовий мембранний фільтр із порами 0,22 мкм (Minisart, Sartoriusstedium, Biotechcorp.); 5) у холостому режимі проводили циркуляцію АК протягом 5–7 хвилин, потім повністю зливали з оксигенатора. Далі використовували стандартизований первинний об’єм заповнення оксигенато–
ра [23].
Методом еліпсометрії встановлена кінетика адсорбції альбуміну на поверхні полімеру, з якого виготовляють магістралі для оксигенатора. Метод дозволяє визначити характеристику шару на поверхні товщиною в 0,01 нм (рис. 1).
Для загального знеболювання на етапах до і після ШК використовували низькопотокову інгаляційну анестезію севофлураном, під час ШК анестезія проводилася пропофолом за стандартними методиками. Перфузія проводилася в режимі непульсуючого кровотоку, використовувався мембранний оксигенатор із первинним об’ємом заповнення 1,5 л для досягнення помірної гемодилюції (Ht 25 ± 2 г/л). Цільові показники кровотоку й середнього перфузійного тиску становили 2,5 л/хв /м² і 60–80 мм рт.ст. відповідно. Середня тривалість перфузії становила 90 ± 20 хв. Відмінність між групами не була статистично значимою.
Для аналізу результатів використано програму MedStat [26]. Під час аналізу використано критерії порівняння для пов’язаних вибірок. Критичний рівень значущості дорівнює 0,05.
Результати та обговорення
Виявлені особливості змін показників стану формених елементів крові під впливом перфузії при кардіохірургічних втручаннях після штучного кровообігу. Аналіз проводився для трьох груп пацієнтів: Gr1 (використання езафосфіни), Gr2 (застосування адаптуючої композиції) і групи контролю. У табл. 1 наведено динаміку показників крові для пацієнтів Gr1, у яких використано езафосфіну.
У групі пацієнтів, у яких після штучного кро–вообігу використано езафосфіну, встановлено (табл. 1) наявність динаміки (p < 0,001) для показника HGB. При цьому за 10 хв ШК відбулося зниження (p < 0,05) цього показника порівняно з початковим значенням (124,0 ± 17,3 г/л). У подальшому значення показника поступово підвищувалося (p < 0,05), але і після ШК (95,3 ± 11,5 г/л) не досягло (p < 0,05) початкового значення.
Показник RBC продемонстрував схожу динаміку (p < 0,001) — початкове зниження (p < 0,05), хоча між показниками на 10–й і 60–й хвилині ШК відмінності не виявлено (p > 0,05). Значення показника RBC після ШК (3,10 ± 0,37 ´ 1012) зросло (p < 0,05) порівняно з 60–ю хвилиною ШК (2,85 ± 0,36 ´ 1012), однак не досягло (p < 0,05) початкового значення (4,17 ± 0,53 ´ 1012).
Аналогічні зміни (p < 0,001) відбулися і для показника HCT: зниження за 10 хв ШК (p < 0,05) порівняно з початковим значенням (37,6 ± 5,4 %), плато на 10–й і 60–й хвилині ШК — відмінності не виявлено (p > 0,05), і зростання (p < 0,05) значення показника після ШК (27,5 ± 3,6 %) порівняно з 60–ю хвилиною ШК (25,1 ± 3,6 %), проте значення показника HCT після ШК не досягло (p < 0,05) початкового значення.
Розглядаючи зміни в стані крові пацієнтів після штучного кровообігу при використанні адаптуючої композиції (табл. 2), необхідно відзначити наступне. Показники HGB, RBC, HCT змінювалися аналогічно до показників у Gr1 і контрольній групі (табл. 1, 3). Об’єм крововтрати у всіх групах становив 250 ± 50 мл. Отримані результати свідчать про те, що зниження показників HGB, RBC, HCT відбувається за рахунок гемодилюції внаслідок використання розчинів для кардіоплегії.
Що стосується показника гемолізу для Gr1, то на 10–й хвилині ШК його значення (0,19 ± 0,23 г/л) не відрізнялося (p > 0,05) від початкового (0,15 ± ± 0,08 г/л). Для Gr2 і Gr3 на 10–й хвилині ШК показники гемолізу змінювались у бік збільшення (табл. 2, 3) і були статистично значущі (р < 0,001). Починаючи з 60–ї хв і після ШК показники гемолізу підвищились у всіх трьох групах (р < 0,001). При проведенні аналізу для трьох груп порівняння не виявлено відмінності у значенні показника гемолізу до проведення ШК (p = 0,05). Проте вже на 10–й хвилині ШК виявлено відмінність показника гемолізу між групами (p = 0,03), при цьому його значення у Gr2 було нижчим (p < 0,05), ніж у групі контролю. На 60–й хвилині ШК і після ШК виявлена відмінність у значеннях показника гемолізу за критерієм Данна між Gr1 і Gr2 та групою контролю (p < 0,05) (рис. 2). Отже, використання у хворих під час штучного кровообігу езафосфіни й адаптуючої композиції істотно зменшує розвиток гемолізу.
Нами встановлено, що на доопераційному етапі гіпофосфатемія була виявлена у 12,5 % пацієнтів (10 хворих), у 25 % (16 хворих) простежувалася чітка тенденція до неї, що свідчить про початковий енергетичний дефіцит у даної категорії хворих.
Значення показника фосфору для групи пацієнтів, у яких в процесі штучного кровообігу використано езафосфіну, після ШК становило 1,85 ± 0,32 ммоль/л і було статистично значимо (p < 0,001) вищим, ніж на початку процедури (1,15 ± ± 0,25 ммоль/л) (табл. 1). У процесі проведення штучного кровообігу значення показника фосфору для групи пацієнтів, у яких використано адаптуючу композицію, становило 0,92 ± 0,30 ммоль/л і статистично значимо (p < 0,07) не відрізнялось від показника на початку процедури (1,04 ± 0,21 ммоль/л) (табл. 2). У контрольній групі значення показника фосфору становило 0,86 ± 0,23 ммоль/л і було статистично значимо (p < 0,001) нижчим, ніж на початку процедури (1,1 ± 0,2 ммоль/л) (табл. 3).
При проведенні аналізу значень показника фосфору не виявлено відмінності для трьох груп порівняння до проведення ШК (pиc. 3). Після ШК виявлено відмінність показника фосфору між групами (p < 0,001), при цьому його значення у Gr1 було вищим (p < 0,05), ніж у двох інших групах. Отже, внутрішньовенне введення езафосфіни приводить до корекції гіпофосфатемії.
Зміна еритроцитарних індексів (МСV, MCH, MCHC) пацієнтів після застосування АШК з використанням езафосфіни продемонструвала таку динаміку. Значення показника МСV на 10–й хвилині ШК знизилось (p < 0,05) порівняно з початковим значенням. На 60–й хвилині ШК (зігрівання) показник МСV досяг найменшого рівня (p < 0,05) порівняно з усіма іншими результатами вимірювань. Після ШК значення показника МСV підвищилося (p < 0,05) порівняно зі значенням на 60–й хвилині ШК, однак не досягло початкового (p < 0,05). Спостерігається динаміка (p < 0,001) показників МСН, МСНС. При цьому на 10–й і 60–й хв ШК відбулося збільшення (p < 0,05) цих показників порівняно з початковим значенням, після ШК показник МСН збільшився, а МСНС зменшився, але обидва показники були вищими, ніж на початку перфузії (p < 0,001). У Gr2 показник МСV також змінювався (p < 0,001), його значення за 10 хв ШК знизилось (p < 0,05) порівняно з початковим. На 60–й хвилині ШК (зігрівання) значення показника МСV досягло найменшого (р < 0,001) рівня порівняно з усіма іншими результатами вимірювання. Після ШК значення показника МСV підвищилося (p < 0,05) порівняно зі значенням на 60–й хвилині ШК, однак не досягло початкового рівня (p < 0,05). Динаміка для показників МСН (р = 0,02), МСНС (р = 0,01) до ШК і після перфузії була статистично значимою (р < 0,05) і відрізнялась на 10–й хвилині перфузії й після ШК у бік збільшення показників, а на 60–й хвилині — у бік зменшення (табл. 2). У Gr3 зміна показника МСV була такою ж, як у Gr2, а динаміка МСН, МСНС (р < 0,001) відзначалася тенденцією до збільшення на 10–й і 60–й хвилині ШК, зі зменшенням після ШК. При порівнянні даних трьох груп середня концентрація гемоглобіну, що відображає ступінь насичення еритроцита гемоглобіном, була вищою у Gr1, у якій проводилось кардіохірургічне втручання зі штучним кровообігом із використанням препарату езафосфіна.
У табл. 2 наведено динаміку показників крові для пацієнтів Gr2, у яких використано адаптуючу композицію.
У табл. 3 наведено динаміку показників крові для пацієнтів групи контролю.
При аналізі показника кількості лейкоцитів не виявлено відмінності між трьома групами порівняння до проведення ШК (табл. 1–3). Після ШК виявлено відмінність у кількості лейкоцитів між групами (p < 0,05), при цьому даний показник на 60–й хвилині ШК у контрольній групі було вищим (p < 0,05), ніж у двох інших групах. З огляду на те, що зміна кількості лейкоцитів у групах відбулася в період ШК на тлі застосування контура екстракорпорального кровообігу без впливу інших факторів, вона може бути пов’язана із системною запальною відповіддю.
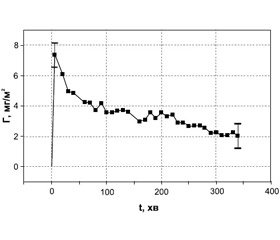
Одним із маркерів адекватності доставки кисню до клітин організму може служити рівень насичення венозної крові киснем (венозна сатурація), який відображає кількість кисню, що залишається в крові після її проходження через капілярне русло, де відбувається екстракція кисню. Зміни змішаної венозної сатурації (ЗВС) вірогідно відображають адекватність споживання кисню. При проведенні штучного кровообігу в непульсуючому режимі перфузії були зареєстровані параметри центральної змішаної венозної сатурації (напруга кисню в змішаній венозній крові — РvO2) для двох груп порівняння — Gr1, у якій використовувалася езафосфіна, і Gr3 (конт–рольної групи) (рис. 4) .
На рис. 4 можна бачити, що РvO2 у Gr1, у якій застосовувалася езафосфіна, протягом ШК була істотно вищою, ніж у Gr3 (p < 0,05). Ці дані доводять, що терапія езафосфіною швидко й ефективно збільшує вміст 2,3–ДФГ у крові, концентрацію кисню без збільшення навантаження на серце [13, 14]. Зміни ЗВС вірогідно відображають динаміку серцевого індексу й розвиваються раніше, ніж зміни артеріального тиску й частоти серцевих скорочень [24, 25]. Доведено, що зниження ЗВС < 65 % асоціювалося з більшою частотою розвитку ускладнень, особливо аритмій [24].
Висновки
1. Використання фруктозо–1,6–дифосфату (езафосфіна) за запропонованою методикою приводить до корекції гіпофосфатемії, покращує постачання клітин киснем, підвищує опірність гемолізу, збільшує запас багатих енергією фосфорних сполук.
2. Застосування езафосфіни й адаптуючої композиції позитивно впливає на морфометричний стан еритроцитів, зменшує вплив гіпоксії на появу в мазках крові ехіноцитів.
3. Доведено, що оптимізація методу штучного кровообігу при проведенні кардіохірургічних операцій можлива за рахунок впливу: введення фруктозо–1,6–дифосфату (езафосфіна) за схемою: 5 г препарату внутрішньовенно краплинно безпосередньо перед початком перфузії та 5 г на 30–й хвилині штучного кровообігу.
4. Доведено, що перспективним напрямком є обробка внутрішньої поверхні контура оксигенатора наношаром автобілка сироватки крові пацієнта, що зменшує місцеве асептичне запалення.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Влияние комбинированной анестезии на развитие окислительного стресса эритроцитов в зависимости от режима перфузии при операциях аортокоронарного шунтирования / Ильиных Т.Ю., Галян С.Л., Кадочников Д.Ю., Баранов В.Н. // Вестник Российской военно–медицинской академии. — 2014. — № 3(47). — С. 45–48.
2. Локшин Л.С., Лурье Г.О., Дементьева И.И. Искусственное и вспомогательное кровообращение в сердечно–сосудистой хирургии: Практическое пособие. — М.,
2003. — 93 с.
3. Мальцева И.В. Характеристика резистентности эритроцитов у кардиохирургических больных с различной степенью выраженности постперфузионного гемолиза // Бюллетень сибирской медицины. — 2013. — Т. 12, № 1. — С. 69–74. DOI: 10.20538/1682–0363–2013–1–69–74.
4. Борисов Ю.А., Спиридонов В.Н., Суглобова Е.Д. Резистентность эритроцитарных мембран: механизмы, тесты, оценка (обзор литературы) // Клинич. лаб. диагностика. — 2007. — № 12. — С. 36–39.
5. Svenmarker S., Jansson E., Stenlund H., Engström K.G. Red bood cell trauma during cardiopulmonary bypass narrow porefilterability versus free haemoglobin // Perfusion. — 2000 Jan. — 15(1). — 33–40. DOI: 10.1177/026765910001500106.
6. Grygorczyk R., Orlov S.N. Effects of Hypoxia on Erythrocyte Membrane Properties — Implications for Intravascular Hemolysis and Purinergic Control of Blood Flow // Mini review published: 22 December 2017. doi: 10.3389/fphys.2017.01110 Frontiers in Physiology | www.frontiersin.org 1 December 2017 | Volume 8 | Article 1110.
7. Хохлов О.А. Роль нарушений структурной организации мембраны эритроцитов в интраоперационном гемолизе при искусственном кровообращении: Автореф. дис… канд. мед. наук. — Томск, 2013. — 23 с.
8. Hemolysis is a primary ATP–release mechanism in human erythrocytes // Blood. — 2014 Sep 25. — 124(13). — 2150–2157. — Prepublished online 2014 Aug 5. doi: 10.1182/blood–2014–05–572024
9. Овчинникова О.А., Тихомирова И.А. Реологические свойства крови в условиях модификации энергетического баланса эритроцитов // Ярославский педагогический вестник. — 2012 — Т. 3, № 3. — С. 134–139.
10. Sprague R., Ellsworth M., Stephenson A., Kleinhenz M. Deformation–induced ATP release from red blood cells requires CFTR activity // American Physiological Society. — 2010. — Н1726–Р1732. PMID: 9815080
11. Cohen J., Kogan A., Sahar G., Lev S., Vidne B., Singer P. Hypophosphatemia following open heart surgery: incidence and consequences // European Journal of Cardiothoracic Surgery. — 2004. — 26. — 306–10. DOI: 10.1016/j.ejcts.2004.03.004.
12. Heames R.M., Cope R.A. Hypophosphataemia causing profound cardiac failure after cardiac surgery // Anaesthesia. — 2006. — 61. — Р. 1211–1213. doi:10.111/j.1365–
2044.2006.04839.
13. Myocardial Protection Using Fructose–1,6–Diphosphate During Coronary Artery Bypass Graft Surgery: A Randomized, Placebo–Controlled Clinical Trial / B.J. Riedel, J. Gal, G. Ellis, P.J. Marangos, A.W. Fox, D. Royston // Anesth. Analg. — 2004. — 98. — 20–9.
14. Gaasbeek A., Meinders AE. Hypophosphatemia: an update on its etiology and treatment // Am. J. Med. — 2005 Oct. — 118(10). — 1094–101. DOI: 10.1016/j.amjmed.2005.02.014.
15. Dieleman J.M., Peelen L.M., Coulson T.G., Tran L., Reid C.M., Smith J.A., Myles P.S., Pilcher D. Age and other perioperative risk factors for postoperative systemic inflammatory response syndrome after cardiac surgery // Br. J. Anaesth. — 2017 Oct 1. — 119(4). — 637–644. doi: 10.1093/bja/aex239.
16. Гончарук А.В., Федерякин Д.В., Анохин А.В., Козачук А.В., Козлов С.Е. Анализ системного воспалительного ответа при использовании различных методик искусственного кровообращения // Клин. и эксперимент. хир. журн. им. акад. Б.В. Петровского. — 2017. — № 1. — С. 78–83.
17. Major M.R., Wong V.M., Nelson E.R., Longaker M.T. The foreign body response: at the interface of surgery and bioengineering // Plast. Reconstr. Surg. — 2015 May. — 135(5). — 1489–98. doi: 10.1097/PRS.0000000000001193.
18. Sotir Lako, Teuta Dedej, Tatjana Nurka, Vera Ostreni, Aurel Demiraj, Roland Xhaxho, Edin Prifti. Hematological Changes in Patients Undergoing Coronary Artery Bypass Surgery: a Prospective Study // Med. Arh. — 2015 Jun. — 69(3). — 181–186.
19. Мороз В.В., Салмина А.Б., Фурсов А.А., Михутки– на С.В., Линев К.А., Шахмаева С.В. Новые аспекты развития системной воспалительной реакции после аортокоронарного шунтирования // Общая реаниматология. — 2008. — Т. ІV, № 6. — С. 5–8.
20. Алексеева Т.А., Сморжевский В.И., Лазаренко О.Н., Тиньков В. А., Береговой О.В., Ошкадеров С.П. Изменение поверхности стентов после нахождения в организме (эксперементальное исследование) // Клінічна хірургія. — 2010. — № 11–12. — С. 4.
21. Дружина А.Н. Влияние ультрафильтрации крови на иммунный ответ организма при проведении искусственного кровообращения у детей // Вісник проблем біології і медицини. — 2013. — Вип. 2 (100). — С. 142–145.
22. Клінічне застосування обробки поверхні імплантатів адаптуючою композицією для поліпшення їх біосумісних властивостей у реконструктивно–відновлювальній хірургії: Методичні рекомендації / М.Т. Картель, О.М. Лазаренко, Т.А. Алексєєва, І.В. Бойко, В.Й. Сморжевський та ін. — К., 2016. — 22 с.
23. Собанська Л.О., Тополов П.О., Куриленко Я.В., Дьордяй І.С., Белемець Н.І., Лазаренко О.М., Лазаренко Г.О., Литвин П.М. Використання принципу адаптуючої композиції при втручаннях з використанням АКШ // Нові досягнення у галузі медичних та фармацевтичних наук: Збірник тез наукових робіт. 18–19 листопада 2016 р. — Одеса, 2016. — С. 60–63.
24. Сметкин А.А., Киров М.Ю. Мониторинг венозной сатурации в анестезиологии и интенсивной терапии // Общая реаниматология. — 2008. — Т. IV, № 4. — С. 86–90.
25. Svenmarker S., Hannuksela M., Haney M. A retrospective analysis of the mixed venous oxygen saturation as the target for systemic blood flow control during cardiopulmonary bypass // Perfusion. — 2018 Sep. — 33(6). — 453–462. Doi: 10.1177/0267659118766437.
26. Лях Ю.Е. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStst / Ю.Е. Лях, В.Г. Гурьянов, В.Н. Хоменко, О.А. Панченко. — Д.: Папакица Е.К., 2006. — 214 с.

/138-1.jpg)
/139-1.jpg)
/140-1.jpg)
/141-1.jpg)
/141-2.jpg)
/142-1.jpg)